
Трансферрин
- Трансферрин является гликопротеином в плазме кровиТрансферрины - это гликопротеины плазмы крови, связывающие железо, которые контролируют уровень свободного железа (Fe) в биологических жидкостях. Человеческий трансферрин, вырабатываемый в печени, кодируется геном TF и представляет собой гликопротеин 76 кДа. Гликопротеины трансферрина связывают железо плотно, но обратимо.
Хотя железо, связанное с трансферрином, составляет менее 0,1% (4 мг) от общего количества железа в организме, оно образует самый жизненно важный пул железа с самой высокой скоростью обмена (25 мг / 24 ч). Трансферрин имеет молекулярную массу около 80 кДа и содержит два специфических высокоаффинных сайта связывания Fe (III). Сродство трансферрина к Fe (III) является чрезвычайно высоким (константа ассоциации составляет 1020 М -1 при рН 7,4), но постепенно снижается при снижении рН ниже нейтрального. Трансферрины не ограничиваются только связыванием с железом, но также с различными ионами металлов. Эти гликопротеины находятся в различных жидкостях организма позвоночных. У некоторых беспозвоночных есть белки, которые действуют как трансферрин, найденный в гемолимфе. Если трансферрин не связан с железом, он известен как «апотрансферрин».
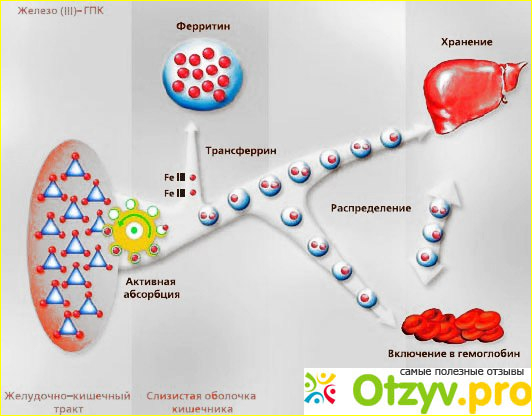
Транспортный механизм
Когда белок трансферрина, содержащий железо, сталкивается с рецептором трансферрина на поверхности клетки, например, предшественниками эритроида в костном мозге, он связывается с ним и транспортируется в клетку в пузырьке посредством опосредованного рецептором эндоцитоза. PH пузырька снижается с помощью водородных ионных насосов (H + АТФазы) примерно до 5,5, в результате чего трансферрин высвобождает ионы железа. Скорость выделения железа зависит от нескольких факторов, включая уровни pH, взаимодействия между долями, температурой, солью и хелатором. Рецептор с его лиганд-связанным трансферрином затем транспортируется через эндоцитарный цикл обратно на клеточную поверхность, готовый к следующему циклу поглощения железа. Каждая молекула трансферрина обладает способностью переносить два иона железа в форме трехвалентного железа (Fe3 +). Ген, кодирующий трансферрин у человека, находится в хромосомной полосе 3q21. Врачи могут проверить уровень трансферрина в сыворотке крови при дефиците железа и при нарушениях перегрузки железом, таких как гемохроматоз.
Структура
Структурно говоря, Трансферрин представляет собой полипептидную цепь, состоящую из двух углеводных цепей и почти семисот аминокислот. Трансферрин имеет две гомологичные глобулярные доли, N- и С-концы, состоящие из альфа-спиралей и бета-листов, с участком связывания железа между ними. Само соединение представляет собой шесть железных координатных соединений, занятых карбонатным анионом и четырьмя остатками. Каждая доля дополнительно разделена на две расщелины или домены. Важно отметить, что эта структура дает трансферрину возможность претерпевать большие конформационные изменения при необходимости поглощения или выделения железа. Это стало возможным благодаря вращающимся доменам, которые вращаются вокруг оси винта. С помощью рентгеновской кристаллографии ученые раскрыли механизм выделения железа. Это заключается в том, как два основных остатка из двух доменов будут создавать особую водородную связь при нейтральном pH; однако эта связь разорвется и, таким образом, высвободит железо при кислотном рН эндосомы в месте ее доставки. Каждая молекула трансферрина способна нести две молекулы железа в кровоток.
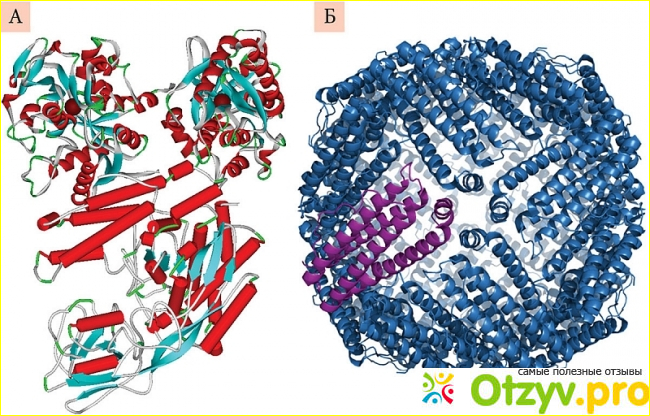
Функция трансферрина
Железо встречается повсюду на земле, поэтому неудивительно, что оно также жизненно важно для поддержания жизни. Люди используют железо для многих клеточных процессов, но, возможно, наиболее важным является способность железа связывать кислород. Как мы знаем, кислород является основополагающим для клеточного дыхания, и поэтому необходимо транспортировать кислород из наших легких в каждую отдельную аэробную клетку - не позволяя радикальному кислороду свободно перемещаться и разрушать мембраны нашей клетки. Безопасный трансфер по нашей системе кровообращения - вот ответ. В то время как около 3,7 грамма железа содержится в нашем организме, большая часть которого поступает из нашего питания, 2,5 грамма находятся внутри гемоглобина железом. Затем гемоглобин может взять на себя роль в транспортировке кислорода через кровь.
Плазменный трансферрин играет важную роль в метаболизме железа. Трансферрин существенно ограничивает уровни свободного железа в крови. Свободное железо опасно тем, что оно несет в себе риск запуска свободнорадикальных реакций, которые вызывают окисление липидов и разрушение тысяч молекул. Свободные радикалы определяются как имеющие, по крайней мере, один неспаренный электрон, и поэтому их заставляют красть электроны из каждой клеточной ткани, включая сердце, поджелудочную железу, мозг и т. д. Повреждение свободных радикалов, вызванное железом, может, таким образом, способствовать развитию болезней сердца и печени, неврологических. К счастью, трансферрин связывает практически все циркулирующее плазменное железо. Это хелатирование делает железо растворимым и нетоксичным, поскольку оно доставляется в ткани, соответственно, оно выполняет функции по превращению железа в растворимый, предотвращает вызванное железом повреждение свободных радикалов и транспортирует железо. Трансферрин, по сути, является наиболее ценным источником железа для эритроцитов, с самым высоким оборотом. Трансферрин, который циркулирует в крови, вырабатывается и выделяется печенью.
Трансферрин и Наномедицина
Многие лекарства препятствуют лечению через гематоэнцефалический барьер, приводя к плохому усвоению в областях мозга. Гликопротеины трансферрина способны обходить гематоэнцефалический барьер через рецептор-опосредованный транспорт к рецепторам трансферрина, обнаруженным в эндотелиальных клетках капилляров мозга. Из-за этой функциональности теоретически предполагается, что наночастицы, действующие как носители лекарств, связанные с гликопротеинами трансферрина, могут проникать через гематоэнцефалический барьер, позволяя этим веществам достигать пораженных клеток мозга. Прогресс в использовании наночастиц, конъюгированных с трансферрином, может привести к неинвазивному распределению лекарств в мозге с потенциальными терапевтическими последствиями заболеваний, нацеленных на центральную нервную систему (ЦНС) (например, болезнь Альцгеймера или Паркинсона).
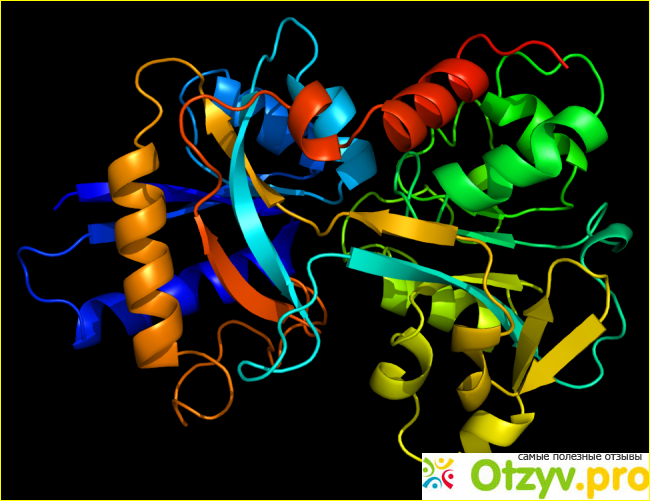
Углеводородный дефицит трансферрина увеличивается в крови при большом потреблении этанола и может контролироваться с помощью лабораторных испытаний. Трансферрин является белком острой фазы и поэтому уменьшает воспаление, рак и некоторые заболевания. При нефротическом синдроме потеря в моче трансферрина, наряду с другими сывороточными белками, такими как тироксин-связывающий глобулин, гаммаглобулин и антитромбин III, может проявляться железо-резистентной микроцитарной анемией. Высокий уровень трансферрина может указывать на железодефицитную анемию. Уровни сывороточного железа и общей железосвязывающей способности (TIBC) используются в сочетании с трансферрином для определения любой аномалии.
Видео обзор
| Все(1) |
|---|
 Трансферрин Трансферрин |





Комментарии на отзыв: