Суть продукта, обзор характеристики:
Обзор: Коллаген гиалуроновой отзывы важное соединение организмаВажное соединение организма. Коллаген гиалуроновой отзывы
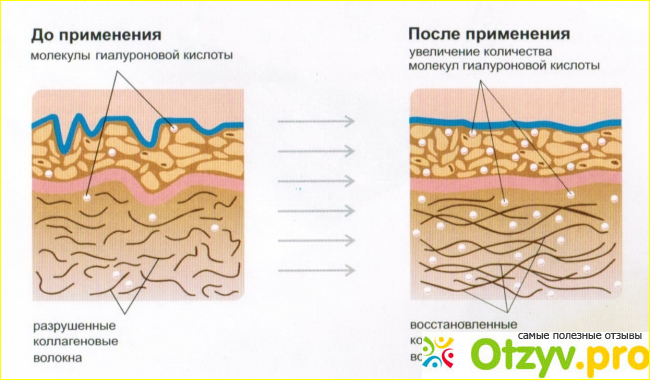
Коллаген как структурный элемент организма
Коллагены являются группой структурных белков, которые характерны исключительно для многоклеточных животных, включая человека (главным образом в виде волоконных пучков, образующих «белок»). Они отмечены в соединительной ткани и внктриклеточном матриксе. Эти соединения обнаруживаются, среди прочего, в белых не эластичных волокнах сухожилий, связок, костей и хрящей.
Кожа во многом также состоит из коллагенов.
Синтез коллагена в организме
Коллаген в основном производится в фибробластами, хондробластами, остеобластами и одонтобластами, но может также синтезироваться во многих других типах клеток. Лучшие исследования проводились по изучению биосинтеза коллагена в фибробластах. Фибробласты имеют обширный шероховатый эндоплазматический ретикулум и хорошо развитый аппарат Гольджи для участия в секреции коллагенов во внеклеточный матрикс. Фибробласты продуцируют коллаген de novo и поставляют его во внеклеточное пространство. Кроме того, фибробласты способны расщеплять коллаген с помощью ферментов, называемых коллагеназами.
Стадии биосинтеза коллагена в организме
Процесс образование данных жизненных белков является сложным и протекает по ступенчатому типу.
1. Транскрипция. На сегодняшний день известно 42 гена, которые участвуют в биосинтезе коллагена и кодируют 28 различных типов коллагена. Каждый ген кодирует определенную последовательность мРНК, а имя гена обычно содержит COL в качестве префикса. Синтез начинается с активации определенных генов, которые ответственны за образование определенных альфа-пептидов. В основном это альфа-пептиды ?1, ?2 или ?3.
2. Трансляция: как только мРНК достигает цитоплазмы из ядра клетки, мРНК соединяется для трансляции с рибосомными субъединицами с образованием препро-?-цепей (также называемых препропептидом). Эти препро-?-цепи содержат сигнальную последовательность на N-конце. Эта сигнальная последовательность распознается частицей распознавания сигнала на шероховатом эндоплазматическом ретикулуме, так что цепь может попасть в просвет шероховатой эндоплазматической сети.
3. Препро-?-цепь для проколлагена. Для образования ?-цепи необходимы три модификации препро-?-цепи. Затем следует формирование тройной спирали из трех альфа-цепей для проколлагена.
Расщепление сигнальной последовательности: сигнальная последовательность на N-конце препро-?-цепи расщепляется сигнальными пептидазами, и образуется про-?-цепь, которая снабжена N- и С-концевыми пропептидами.

Гидроксилирование: в эндоплазматическом ретикулуме ОН-группы присоединены к отдельным остаткам пролина и лизина существующих или уже сформированных полипептидных цепей (гидроксилирование). Аскорбиновая кислота (витамин С) является важным кофактором в гидроксилировании аминокислотного пролина к гидроксипролину с помощью фермента пролил-4-гидроксилазы и лизина до гидроксилизина с помощью фермента лизилгидроксилазы. Гидроксипролин обладает функцией усиления тройной спирали в молекуле коллагена посредством водородных связей между соседними полипептидными цепями коллагена. Гидроксилизин служит для закрепления ковалентных поперечных связей между молекулами коллагена. В отсутствие гидроксилирования образуются только дефектные молекулы коллагена, которые не могут функционировать как структурный белок. Следует отметить, что почти все симптомы цинга при дефиците аскорбиновой кислоты обусловлены дефектным биосинтезом коллагена.
Гликозилирование. Наконец, некоторые остатки лизина обычно гликозилируются ферментами проколлаген-галактозилтрансферазой, проколлаген-глюкозилтрансферазой или другими ферментами гликозилирования. Была синтезирована коллагеновая альфа-цепь.
Образование тройной спирали. Образование тройной спирали инициируется образованием дисульфидных связей между С-концевыми пропептидами с использованием дисульфид-изомеразы белка. Три альфа-цепи образуют трехцепочечную спиральную молекулу, проколлаген, через водородные связи.
4. Секреция и транспортировка проколлагена в аппарат Гольджи. Из-за размера молекул проколлагена (около 300 нанометров) они не вписываются в нормальные пузырьки (50–90 нм) эндоплазматического ретикулума. Для обеспечения транспорта копия белка убиквитина связана с SEC31 белкового комплекса SEC13-SEC31 ферментом CUL3-KLHL12, так что размер транспортных пузырьков можно изменить. Трансмембранный белок TANGO1 также участвует в координации секреции проколлагена. После того, как проколлаген был упакован в модифицированные транспортные пузырьки, его можно транспортировать в аппарат Гольджи.
5. Модификация в аппарате Гольджи: последняя посттрансляционная модификация проколлагена происходит в аппарате Гольджи путем добавления и модификации олигосахаридов. Какие ферменты ответственны за модификацию связанных с N-концом олигосахаридов, зависит от места посттрансляционной модификации в аппарате Гольджи.
6. Транспорт от аппарата Гольджи к плазматической мембране и последующий экзоцитоз во внеклеточный матрикс. Секреторные везикулы, которые связываются на транс-стороне сети транс-Гольджи, известны как носители Гольджи с носителями плазматических мембран. Проколлаген транспортируется к плазматической мембране, точнее к выступам плазматической мембраны, так называемым фибропозиторам. Тройно-спиральные молекулы коллагена высвобождаются из клетки. Молекулы высвобождаются во внеклеточное пространство путем экзоцитоза с основанием фибрипозитора, в котором, по-видимому, участвуют гликозильные компоненты.
7. Образование тропоколлагена. Сразу после доставки из клетки пропептиды расщепляются с использованием специфических ферментов проколлагеновых пептидаз. Фермент проколлаген-N-эндопептидаза необходим для расщепления аминоконцевых последовательностей, тогда как фермент проколлаген-С-эндопептидаза расщепляет карбоксиконцевые проколлагеновые последовательности. Тропоколлаген таким образом является сформированным.
8. Фибриллогенез. После разделения проколлагеновых пептидов отдельные молекулы тропоколлагена собираются в фибриллы коллагена (фибриллогенез). Другие молекулы могут прикрепляться к фибриллам и таким образом регулировать диаметр фибрилл. К ним относятся так называемые малые лейцин-богатые повторные протеогликаны, которые включают, такие соединения, как декорин, фибромодулин и люмикан.
9. Сшивание. После слипания отдельных трехспиральных молекул тропоколлагена, смещенных на одну пятую их длины, происходит ковалентное сшивание через близлежащие гидроксилизиновые остатки, которые необходимо преобразовать, что надолго фиксирует пространственное расположение. Остатки гидроксилизина (созданные внутриклеточно лизилгидроксилазой) окисляются до аллизина ферментом лизилоксидазой. Два соседних остатка аллизина претерпевают альдольную конденсацию, с помощью которой эта часть фиксируется постоянным сшиванием. таким образом происходит формирование сшитых коллагеновых фибрилл.
Перед применением обязательно проконсультируйтесь со специалистом
Видео обзор
| Все(1) |
|---|
 Коллаген гиалуроновой отзывы Коллаген гиалуроновой отзывы |






Комментарии на отзыв: